Ножницы для генома: как генная инженерия спасает жизни
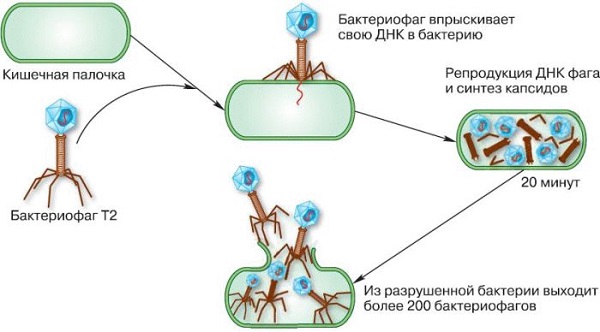 |
| Взаимодействие вируса с бактерией. Иллюстрация в учебнике по биологии Николая Сонина |
Бактериофаги — вирусы, поражающие бактерии
Оказывается, сами бактерии тоже могут «заболеть», если их поразят вирусы — меньшие их по размерам и примитивнейшие по строению. Вирус прикрепляется к бактерии и «впрыскивает» в нее собственную ДНК — длинную молекулу, в которой, как в книге, записана информация о его строении. Эта информация встраивается в ДНК бактерии, и она начинает считывать и воплощать в жизнь не собственный «жизненный код», а вирусный. Образуются новые вирусы, которые выходят, убивая ее.
И так же, как у человека, у бактерий есть системы защиты, иммунитет. Если человек перенес инфекцию или был вакцинирован, его организм запоминает чужеродные частицы и при повторной встрече с ними незамедлительно начинает борьбу. Так же бактерия встраивает в свою ДНК частицы вирусной. Область, куда встраиваются участки вирусной ДНК, ученые назвали CRISPR — эта английская аббревиатура отражает, что данные участки короткие, они расположены группами и повторяются на протяжении всей ДНК. Получается «карта прививок», которую бактерия передает своему потомству.
История изучения CRISPR берет начало еще с 80-х годов прошлого века. Японские ученые заметили, что в молекуле ДНК бактерии кишечной палочки есть одинаковые фрагменты. ДНК — это очень длинная цепочка, в которой закодирована, как азбукой Морзе, информация о «судьбе» клетки. И вновь поражает воображение мудрое устройство природы — длина этой нитевидной молекулы внутри одной клетки составляет порядка двух метров при том, что саму клетку мы можем увидеть лишь под увеличением линз микроскопа! Благодаря изящной упаковке длинной молекулы в микроскопический объем родители могут передавать свои признаки потомству. Поэтому наличие повторяющихся участков в ДНК вызывает вопросы о целесообразности — зачем, например, тиражировать книги, в которых есть одинаковые главы? Этот вопрос привлек внимание исследователей к CRISPR. В 2005 году стала известна защитная, напоминающая иммунитет функция этих молекулярно-генетических структур.
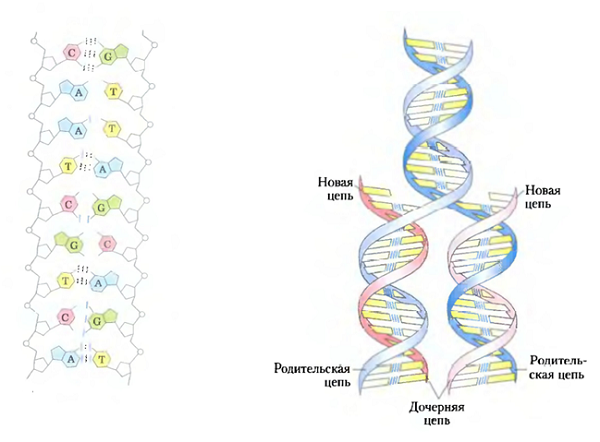 |
| ДНК — это двойная спираль, хранящая генетическую информацию. Каждая из двух ее нитей состоит из нуклеотидов, как бусы из жемчужин, и каждый нуклеотид («жемчужина») связан химической связью со строго подходящим ему нуклеотидом из второй нити. Никакой другой нуклеотид не может быть напротив конкретного нуклеотида, поэтому имея только одну из двух нитей, можно полностью восстановить всю структуру. На этом принципе основаны все процессы, связанные с ДНК, в том числе реализация этой информации, а также ее узнавание и копирование. Адаптировано из учебника биохимии Ленинджера |
Cas9 — это белок, который как бы выполняет функцию часового в клетке бактерии. Название белка связано с тем, что он получает информацию от CRISPR: «C» — первая буква CRISPR, «as» — англ. associated, что значит «взаимосвязанный». Этот белок просматривает всю ДНК, и если вирус, от которого у бактерии уже есть иммунитет, снова впрыскивает в нее свой генетический материал, который встраивается в ее ДНК, то Cas9, словно ножницы, вырезает его. И на протяжении многих лет ученые искали способ использовать эти «ножницы» для редактирования генетического материала.
Эммануэль Шарпантье впервые разработала такую технологию для редактирования ДНК бактерии, а Дженнифер Дудна видоизменила метод так, чтобы с его помощью можно было видоизменять ДНК абсолютно любой клетки. В 2020 году исследовательницы совместно получили Нобелевскую премию по химии за это изобретение. Дженнифер Дудна сравнивает изобретенную технологию с программой исправления опечаток в тексте. На официальном сайте можно ознакомиться с пресс-релизом и посмотреть иллюстративный материал.
Основное преимущество CRISPR/Cas9 перед другими известными способами редактирования генетического материала (например, разработанных в 1990-ые «цинковые пальцы») — это простота и доступность, в том числе с точки зрения финансовых затрат. И это преимущество настолько значимо, что в 2010-х данная технология привлекла внимание многих инвесторов и венчурных капиталистов.
Медицинское применение CRISPR/Cas9
Так как технология CRISPR позволяет вносить изменения в генетический материал клетки, закодированный в молекуле ДНК, область ее применения в медицине, по крайней мере, в первое время, ограничена заболеваниями, передающимися по наследству — генетическими. Например, врожденной патологии дыхательной системы — известен ген, который отвечает за развитие болезни муковисцидоз.
Задолго до получения заслуженной награды Дженнифер Дудна говорила о том, что в первую очередь речь идет о лечении заболеваний крови. Доставить механизм CRISPR/Cas9 внутрь клетки крови представляется более выполнимой задачей, чем доставка в плотные ткани.
В октябре 2015 года CRISPR Therapeutics и Vertex Pharmaceuticals объявили о сотрудничестве в разработке методов редактирования генов. Биотехнологи заявили, что их первоначальный акцент будет сделан на использовании CRISPR-Cas9 для лечения муковисцидоза и серповидноклеточной анемии. Впоследствии было запущено исследование еще одного заболевания крови — бета-талассемии.
Также ведутся исследования с целью излечить одну из форм слепоты — врожденный амавроз Лебера. Пациенты с некоторыми формами онкологических заболеваний, а также ВИЧ-инфицированные лица проходят испытания методов лечения, при которых отбирают клетки их крови, обрабатывают при помощи CRISPR, удаляя кодирующий заболевание ген или вирусные фрагменты, а затем измененные таким образом клетки возвращают в организм. В 2019 году публиковались результаты клинических исследований, при которых при помощи CRISPR были отредактированы ДНК клеток крови человека, страдающего лимфомой. Мышечная дистрофия Дюшенна тоже потенциально излечима этим методом.
Кроме того, в 2020 был разработан CRISPR-тест на COVID-19, его методика также основана на выявлении копий вирусного генома в слюне или образце из носа. Помимо простоты и доступности, тест отличается высокой чувствительностью (точностью выявления заболевания) и специфичностью (точностью определения здоровых лиц). Однако, как и другие основанные на CRISPR технологии, этот метод находится на стадии предварительных исследований, основная цель которых — это проверка не только целесообразности изобретенных методов диагностики и лечения, но и их безопасности.
Нерешенные вопросы
CRISPR оказался мощным инструментом для работы с генетической информацией. По этой причине крайне важно, чтобы процессы, запускаемые этой технологией, были полностью контролируемы и управляемы. Нужно минимизировать связанные с ней побочные эффекты и нежелательные явления.
Одна из задач, решенная исследователями — это способ доставки частиц внутрь клетки. Для этого необходимо, чтобы в оболочке клетки — мембране — появились отверстия, через которые механизм может пройти. Это осуществимо, например, при помощи электричества. Проникнув в клетку, CRISPR, специально запрограммированный для работы с конкретной последовательностью ДНК, находит и вырезает ген, который является причиной развития болезни. При этом важна высокоточная работа механизма, так как изменениям подвергаются структуры, не видные даже в микроскоп, а при ошибке последствия могут развиться на уровне целого организма. Принцип, лежащий в основе технологии CRISPR, отличается высокой точностью узнавания запрограммированной последовательности.
Эксперименты с целью поиска новых подходов продолжаются — например, изобретен способ регулирования работы CRISPR при помощи света. Cas9 находит во всей ДНК нужный участок и связывается с ним, но разрезает его не сразу, а только при воздействии светового сигнала.
Важнейшей задачей представляется выявление и устранение причин нежелательных эффектов — как связанных с непреднамеренными изменениями в ДНК, внесенным самим CRISPR, так и возникающих по косвенным механизмам. Они могут быть связаны с тем, что удаленный ген заболевания выполняет и другие функции, которые при его удалении будут нарушены. Поэтому нужны дальнейшие проверки.
Этические проблемы
Еще до получения премии Дженнифер Дудна акцентировала внимание на важности международного обсуждения изобретенной технологии: возможность внесения изменений в ДНК вызывает этические вопросы, потому что технически редактированию может быть подвергнута генетическая программа клетки не только взрослого человека, но и эмбриона, что вызывает закономерную обеспокоенность.
 |
| Эммануэль Шарпантье и Дженнифер Дудна на выставке детских рисунков на тему генетики в Испании, 2015 год Источник: Britannica.com |
Работа по решению этических проблем, связанных с развитием генной инженерии, ведется с 70-х годов прошлого века. Так, в России действует бессрочный запрет на клонирование человека. Кроме того, запрещены любые вмешательства в генетический аппарат половых клеток. Вектор биоэтических дискуссий о допустимости редактирования генома человека с целью программирования желаемых признаков направлен в сторону запрета даже экспериментов такой тематической направленности.
Однако в первую очередь ученые и врачи заинтересованы в открывающейся возможности нового подхода к лечению наследственных заболеваний, что вызывает меньше критики. В частности, в разделе «Проблемы биоэтики» Основ социальной концепции Русской Православной Церкви (2009 год) читаем: «Целью генетического вмешательства не должно быть искусственное «усовершенствование» человеческого рода и вторжение в Божий план о человеке. Поэтому генная терапия может осуществляться только с согласия пациента или его законных представителей и исключительно по медицинским показаниям».
Метод диагностики инфекций на основе технологии CRISPR не подразумевает вмешательства в наследственную информацию клеток человека. Он направлен только на распознавание генетического материала вируса в образцах. В контексте же нынешней эпидемической ситуации становится очевидно: изобретение Дженнифер Дудна и Эммануэль Шарпантье, за которые они были удостоены Нобелевской премии, представляют высочайшую как научную, так и практическую ценность.

















